Polonium (hay còn được gọi là Poloni) là kim loại hiếm có tính phóng xạ cao và chu kỳ bán rã ngắn. Kim loại này được sử dụng trong việc khởi tạo bom ở chiến tranh Thế giới thứ hai, tuy nhiên ngày nay Polonium còn được ứng dụng nhiều trong thí nghiệm, làm nguồn nhiệt nguyên tử, neutron hoặc các chất chống tĩnh điện.
Nội Dung Bài Viết
Polonium là gì?
Polonium là một nguyên tố hóa học có ký hiệu Po với số nguyên tử 84. Nguyên tố này là một chalcogen, thuộc nhóm 16 trong bảng tuần hoàn hóa học.
Đây là một kim loại hiếm, có tính phóng xạ cao nhưng không có đồng vị ổn định. Polonium có tính chất hóa học tương tự như Selenium và Tellurium.
Tất cả các đồng vị của Polonium có chu kỳ bán rã ngắn, nên sự xuất hiện tự nhiên của kim loại này chỉ giới hạn ở những dấu vết nhỏ của Polonium-210 (chu kỳ bán rã 138 ngày) trong quặng Uranium. Do Polonium xuất hiện trong chuỗi phân rã phóng xạ của Uranium-238 và Radium-226.
Ngày nay, Polonium thường được sản xuất với số lượng miligam bằng cách chiếu xạ neutron của bismuth. Do tính phóng xạ mạnh của kim loại này, dẫn đến sự phân giải phóng xạ của các liên kết hóa học và sự tự đốt nóng bằng chất phóng xạ, hóa học của Polonium hầu như chỉ được nghiên cứu trên quy mô vết.

Nguồn gốc của Polonium
Polonium được phát hiện vào tháng 7 năm 1898 bởi vợ chồng Marie Skłodowska-Curie và Pierre Curie, được đặt tên theo quê hương Ba Lan của Marie Curie.
Kim loại này được chiết xuất từ quặng Urani Pitchblende và xác định nhờ tính phóng xạ mạnh, đây là nguyên tố đầu tiên được xác định như vậy.
Polonium có ít ứng dụng trong đời sống, tuy nhiên những ứng dụng này có liên quan đến tính phóng xạ của kim loại như lò sưởi trong tàu thăm dò không gian, thiết bị chống tĩnh điện, nguồn neutron và hạt Alpha, hoặc các chất độc cực kỳ nguy hiểm đối với con người.

Đặc điểm của Polonium
Polonium là có chu kỳ bán rã 138,4 ngày và có khả năng phân rã trực tiếp thành đồng vị con ổn định như Pb-206.
Một miligam Po-210 phát ra số hạt Alpha tương đương với 5 gam Ra-226, có nghĩa là kim loại này có tính phóng xạ gấp 5000 lần so với Radium.
Ngoài ra, một số curie (đơn vị phóng xạ ngoài SI) của Po-210 phát ra ánh sáng xanh gây ra bởi sự ion hóa không khí xung quanh.
Khoảng một trong 100.000 bức xạ Alpha gây ra sự kích thích hạt nhân, dẫn đến sự phát ra tia gamma với năng lượng tối đa lên đến 803 keV.

Trạng thái của Polonium
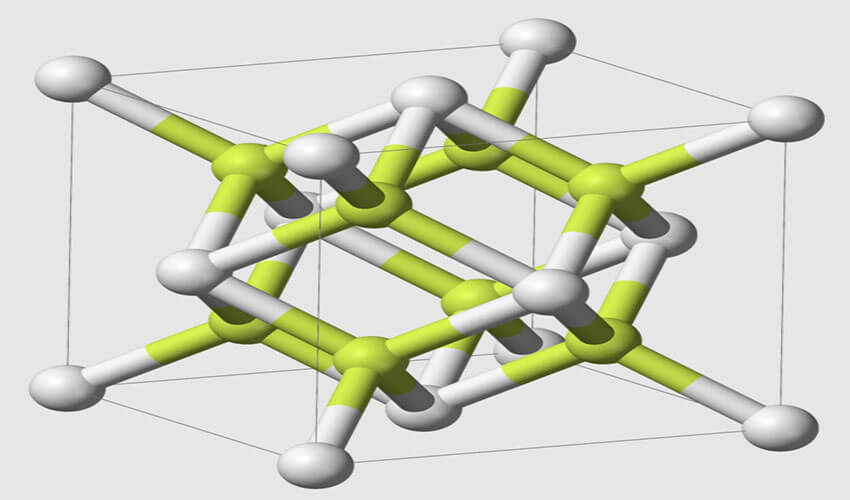
Polonium là một nguyên tố phóng xạ tồn tại ở dạng hai đồng vị kim loại. Dạng Alpha là ví dụ duy nhất được biết về cấu trúc tinh thể lập phương đơn giản trên cơ sở một nguyên tử tại STP, với chiều dài cạnh là 335,2 x 10-12 m, hình thức beta là Rhombohedral.
Cấu trúc của Poloni được đặc trưng bởi nhiễu xạ tia X và nhiễu xạ điện tử.
Po-210 hoặc Pu-238 có khả năng dễ dàng bay trong không khí, nếu một mẫu được làm nóng trong không khí đến 55°C, 50% trong số đó bị bốc hơi trong 45 giờ để tạo thành diatomic phân tử Po2, dù điểm nóng chảy của Polonium là 254 °C và độ sôi lên đến 962 °C.
Tính chất hóa học của Polonium
Tuy có điểm tương đồng với Bismuth về tính chất kim loại nhưng Polonium có tính chất hóa học tương tự như Tellurium. Kim loại này hòa tan dễ dàng trong axit loãng nhưng chỉ hòa tan một chút trong kiềm.
Các dung dịch Polonium đầu tiên có màu hồng bởi các ion Po 2+, nhưng sau đó nhanh chóng chuyển sang màu vàng do bức xạ Alpha từ Polonium làm ion hóa dung môi và chuyển Po 2+ thành Po 4+.
Do Polonium cũng phát ra các hạt Alpha sau khi phân rã nên quá trình này đi kèm với hiện tượng sủi bọt và tỏa nhiệt, ánh sáng bằng đồ thủy tinh bởi các hạt Alpha hấp thụ.
Dung dịch Poloni rất dễ bay hơi trong vòng vài ngày nếu không được đậy kín. Ở độ pH khoảng 1, các ion polonium dễ dàng bị thủy phân và tạo phức bởi các axit như axit oxalic, axit citric và axit tartaric.

Các hợp chất của Polonium
Polonium không có hợp chất phổ biến, tất cả các hợp chất của kim loại này đều được tạo ra bằng phương pháp tổng hợp.
Loại hợp chất Poloni ổn định nhất là Polonide, được điều chế bằng phản ứng trực tiếp của hai nguyên tố.
Hầu hết các Polonua bị phân hủy khi đun nóng đến khoảng 600°C, trừ HgPo bị phân hủy ở 300 °C và các Polonua nhóm Lantan, không bị phân hủy mà tan chảy ở nhiệt độ trên 1000°C.
Ví dụ, Polonide Praseodymium (PrPo) nóng chảy ở 1250 °C và Polonide Thulium (TmPo) nóng chảy ở 2200 °C.
Poloni hydrua (PoH2) là chất lỏng dễ phân ly và bay hơi ở nhiệt độ phòng, kim loại này không có độ bền nhiệt. Ngoài ra, nước là loại Hydro Chalcogenua duy nhất được biết đến ở nhiệt độ phòng, khác với dạng lỏng do liên kết Hydro.
Ba oxit PoO, PoO2 và PoO3 là sản phẩm của quá trình oxy hóa Polonium. Các Halogen của cấu trúc PoX2, PoX4 và PoF6 đã được biết đến với đặc tính tan được trong các Hydro Halogenua tương ứng như PoClX trong HCl, PoBrX trong HBr và PoI4 trong HI.
Poloni Dihalua được hình thành do phản ứng trực tiếp của các nguyên tố hoặc bằng cách khử PoCl4 với SO2, PoBr4 và H2S ở nhiệt độ phòng. Tetrahalua có thể thu được bằng cách phản ứng Polonium Dioxide với HCl, HBr hoặc HI.
Các hợp chất Polonium khác bao gồm Kali Polonite dưới dạng Polonit, Polonat, Axetat, Bromat, Cacbonat, Citrate, Cromat, Xyanua, Formate, Hydroxit (II) và (IV), Nitrat, Selenat, Selenit, Monosulfua, Sunfat, Disulfat và Sulfit.
Một chất hóa học Organo Polonium hạn chế đã được biết đến, hầu hết chỉ giới hạn ở Dialkyl và Diaryl Polonua (R2Po), Triaryl Polonium Halogenua (Ar3PoX) và Dihalogenua Diarylpolonium (Ar2PoX2).
Polonium cũng tạo thành các hợp chất hòa tan với một số tác nhân tạo chelat , chẳng hạn như 2,3-butanediol và thiourea.
Ngoài ra, các hợp chất Polonium còn được ký hiệu như sau:
- Oxit: PoO, PoO2, PoO3.
- Hydrua: PoH2
- Halogenua: PoX2 (ngoại trừ PoF2), PoX4, PoF6, PoBr2Cl2.
Tính chất đồng vị
Polonium là kim loại có 42 đồng vị có tính phóng xạ. Các đồng vị này có khối lượng nguyên tử nằm trong khoảng từ 186 đến 227u.
Po-210 (chu kỳ bán rã 138,376 ngày) là đồng vị phổ biến nhất và được tạo ra thông qua quá trình giữ Neutron bằng Bismuth tự nhiên.
Po-209 tồn tại lâu nhất trong tất cả các đồng vị (chu kỳ bán rã lên đến 3 năm) và Po-208 (chu kỳ bán rã 2,9 năm) có thể được tạo ra thông qua sự bắn phá chì hoặc Bismuth của chì hoặc Bismuth trong cột Cyclotron.

Lịch sử của Polonium
Polonium là nguyên tố đầu tiên được vợ chồng Curies phát hiện khi họ đang điều tra nguyên nhân gây ra hiện tượng phóng xa Pitchblende.
Curie đặt tên cho kim loại này theo quê hương của mình là Ba Lan (tiếng Latinh gọi là Polonia) nhằm công khai sự thiếu độc lập của quốc gia này. Đây là nguyên tố đầu tiên được đặt tên để làm nổi bật một tranh cãi chính trị.
Khi loại bỏ các nguyên tố phóng xạ Uranium và Thorium ra khỏi Pitchblende, nguyên tố này có tính phóng xạ cao hơn cả hai kim loại kia cộng lại.
Vào năm 1902, nhà khoa học người Đức Willy Marckwald cô lập thành công 3 miligam Polonium.
Tại Hoa Kỳ, Polonium là một phần của dự án Manhattan trong Thế chiến thứ hai. Polonium và Berili là thành phần chính của chất khởi tạo “Urchin” ở trung tâm hố hình cầu của quả bom.
“Urchin” đã khởi xướng phản ứng dây chuyền hạt nhân vào thời điểm cấp thiết để đảm bảo rằng vũ khí không bị kích nổ.
Đến khi chiến tranh kết thúc, kim loại này được phân loại và sử dụng như một chất khởi xướng trong các thí nghiệm.

Quá trình xuất hiện và sản xuất Polonium
Quá trình xuất hiện
Polonium là một nguyên tố rất hiếm trong tự nhiên do chu kỳ bán rã ngắn của tất cả các đồng vị của kim loại này.
7 đồng vị xuất hiện ở dạng vết dưới trạng thái sản phẩm phân rã như:
- Po-210, Po-214, Po-218 xuất hiện trong chuỗi phân rã của Uranium-238.
- Po-211 và Po-215 xảy ra trong chuỗi phân rã của Uranium-235.
- Po-212 và Po-216 xảy ra trong chuỗi phân rã của Thorium-232.
Trong các đồng vị này, Po-210 là đồng vị duy nhất có chu kỳ bán rã dài hơn 3 phút.
Polonium có thể được tìm thấy trong quặng Uranium ở mức khoảng 0,1mg mỗi tấn, xấp xỉ 0,2% lượng Radium dồi dào.
Số lượng kim loại được tìm thấy trong lớp vỏ Trái đất không gây ra tác hại cho con người. Ngoài ra, Polonium còn được tìm thấy trong khói thuốc lá từ lá thuốc được trồng bằng phân lân.

Quá trình sản xuất Polonium
Do kim loại này thường xuất hiện với nồng độ nhỏ nên việc cô lập Polonium từ các nguồn tự nhiên rất đơn giản.
Polonium có khối lượng lớn nhất được chiết xuất vào nửa đầu thế kỷ 20, chỉ chứa 40 Ci Po-210 và thu được bằng cách xử lý 37 tấn cặn từ quá trình sản xuất Radium.
Polonium hiện nay thường thu được bằng cách chiếu xạ Bismuth bằng Neutron hoặc Proton năng lượng cao.
Năm 1934, một thí nghiệm cho thấy rằng Bismuth-209 tự nhiên bị Neutron bắn phá và tạo ra Bismuth-210, sau đó phân rã thành Po-210 thông qua quá trình phân rã Beta-âm.
Quá trình tinh chế cuối cùng được thực hiện bằng phương pháp nhiệt hóa cùng kỹ thuật chiết lỏng.
Ngày nay, Polonium có thể được tạo ra với số lượng miligam trong quy trình sử dụng dòng neutron cao được tìm thấy trong các lò phản ứng hạt nhân. Có khoảng 100 gram Po được sản xuất mỗi năm, hầu như tất cả đều ở Nga, làm cho kim loại này trở nên cực kỳ hiếm.
Quá trình này có thể gây ra các vấn đề trong các lò phản ứng hạt nhân làm mát bằng kim loại lỏng dựa trên chì Bismuth như các lò phản ứng đã được sử dụng trong K-27 của Hải quân Liên Xô.
Các biện pháp phải được thực hiện trong các lò phản ứng này để đối phó với khả năng không mong muốn là Po-210 thoát ra từ chất làm mát.
Các đồng vị tồn tại lâu hơn của Polonium như Po-208 và Po-209 có thể được hình thành bởi sự bắn phá proton hoặc deuteron của Bismuth bằng Cyclotron.
Các đồng vị khác thiếu neutron hơn và không có độ ổn định có thể được hình thành bằng cách chiếu xạ bạch kim với hạt nhân carbon.

Ứng dụng Polonium
1. Dùng làm nguồn nhiệt nguyên tử
Các nguồn hạt Alpha dựa trên Polonium được sản xuất ở Liên Xô cũ và áp dụng để đo độ dày của lớp phủ công nghiệp thông qua sự suy giảm bức xạ Alpha.
Do bức xạ Alpha có cường độ cao nên mẫu Po-210 nặng một gam sẽ tự nóng lên đến trên 500 °C, tạo ra khoảng 140 watt điện.
Do đó, Po-210 được sử dụng làm nguồn nhiệt nguyên tử để cung cấp năng lượng cho máy phát nhiệt điện đồng vị phóng xạ thông qua vật liệu nhiệt điện.
Ví dụ: Các nguồn nhiệt Po-210 được sử dụng trong Lunokhod 1(1970) và Lunokhod 2 (1973), xe tự vận hành trên Mặt trăng để giữ ấm cho các bộ phận bên trong của máy.

2. Dùng làm nguồn neutron
Các hạt Alpha được Polonium phát ra có thể chuyển đổi thành Neutron bằng cách sử dụng Berili oxit với tỷ lệ 93 neutron trên một triệu hạt Alpha.
Hỗn hợp Po-BeO được sử dụng làm nguồn Neutron thụ động với tỷ lệ sản xuất tia Gamma trên Neutron là 1,13 ± 0,05, thấp hơn so với các nguồn Neutron dựa trên phản ứng phân hạch hạt nhân.
Ví dụ: Hợp kim Po-BeO được sử dụng làm nguồn Neutron là chất kích hoạt hoặc chất khởi tạo Neutron cho vũ khí hạt nhân và dùng kiểm tra các giếng dầu.
3. Chống tĩnh điện
Polonium cũng là một phần của bàn chải hoặc các công cụ giúp loại bỏ điện tích tĩnh trong các tấm ảnh, nhà máy dệt, cuộn giấy, tấm nhựa và trên các chất nền như ô tô, trước khi áp dụng lớp phủ.
Các hạt Alpha phát ra từ Polonium ion hóa các phân tử không khí, trung hòa điện tích trên các bề mặt gần đó. Một số bàn chải chống tĩnh điện chứa tới 500 microcuries (20 MBq) Po-210 làm nguồn hạt tích điện để trung hòa tĩnh điện.
Tại Hoa Kỳ, các thiết bị có không quá 500 μCi (19 MBq) Po-210 được mua với số lượng bất kỳ mà không cần đăng ký với cơ quan chức năng.
Poloni cần được thay thế trong các thiết bị hàng năm, do thời gian phân rã ngắn và có tính phóng xạ cao. Nên các sản phẩm này được thay thế bằng các nguồn hạt beta ít nguy hiểm hơn.

4. Nghiên cứu khoa học
Đôi khi một lượng nhỏ Po-210 được sử dụng trong phòng thí nghiệm cho mục đích giảng dạy với mức 4-40 kBq, ở dạng nguồn kín và lắng đọng trên chất nền, trong nhựa hoặc ma trận polyme, được các cơ quan chức năng miễn cấp phép do không có tính nguy hiểm.
Một lượng nhỏ Po-210 được sản xuất để bán cho công chúng ở Hoa Kỳ dưới dạng “kim tiêm”, sử dụng cho các thí nghiệm trong phòng thí nghiệm và được bán lẻ bởi các công ty cung cấp các chất phục vụ khoa học.
Polonium được mạ một lớp bằng vật liệu như vàng vàng để sử dụng trong các thí nghiệm như buồng mây, cho phép bức xạ Alpha vượt qua đồng thời ngăn không cho Polonium giải phóng và gây nguy hiểm độc hại.

5. Dùng để đánh lửa trong Bugi
Các Bugi đánh lửa bằng Polonium được bán ra thị trường từ năm 1940 đến năm 1953. Mặc dù lượng bức xạ từ các loại Bugi này rất nhỏ và không gây nguy hiểm cho người tiêu dùng.
Nhưng lợi ích của các Bugi này nhanh chóng giảm đi sau khoảng một tháng, do chu kỳ bán rã ngắn của Polonium. Bởi sự tích tụ trên các dây dẫn sẽ chặn bức xạ giúp cải thiện hiệu suất động cơ.

Tác dụng sinh học và độc tính của Polonium
1. Tổng quan về sinh học và độc tính của Polonium
Poloni có thể nguy hiểm và không có ứng dụng trong sinh học. Về mặt khối lượng, Polo-210 độc hơn khoảng 250.000 lần so với Hydro Xyanua.
Mối nguy hiểm chính là tính phóng xạ mạnh của kim loại này, dưới dạng chất phát Alpha, khiến Poloni khó được xử lý một cách an toàn.
Đối với lượng microgam nhỏ cũng làm cho việc xử lý Po-210 trở nên nguy hiểm, cần có các thiết bị xử lý chuyên dụng như hộp đựng găng tay, Alpha áp suất âm được trang bị bộ lọc hiệu suất cao.
Quy trình này cần được giám sát đầy đủ và xử lý nghiêm ngặt để tránh bất kỳ sự nhiễm bẩn nào.
Các hạt Alpha do Polonium phát ra sẽ dễ dàng làm hỏng mô hữu cơ nếu ăn, hít hoặc hấp thụ Polonium, mặc dù kim loại này không xuyên qua lớp biểu bì. Tuy nhiên, bạn sẽ không gặp bất kỳ nguy hiểm nào nếu các hạt Alpha vẫn ở bên ngoài cơ thể.
Sử dụng găng tay chống hóa chất là một biện pháp phòng ngừa bắt buộc để tránh sự khuếch tán Polonium trực tiếp qua da. Nguyên tố có trong Axit Nitric đậm đặc, có thể dễ dàng khuếch tán hoặc axit có thể làm hỏng găng tay cao su.
Poloni không có đặc tính hóa học độc hại, do có một số vi khuẩn có thể Methyl hóa Poloni nhờ tác dụng của Methylcobalamin. Điều này tương tự như cách thủy ngân, Selenium và Tellurium bị Methyl hóa trong các sinh vật sống để tạo ra các hợp chất cơ kim.
Các nghiên cứu điều tra quá trình chuyển hóa Polonium-210 ở chuột đã chỉ ra rằng chỉ 0,002 đến 0,009% lượng Polonium-210 ăn vào được bài tiết dưới dạng Polonium-210 dễ bay hơi.

Hiệu ứng cấp tính của Polonium
Liều lượng gây chết người trung bình đối với phơi nhiễm phóng xạ cấp tính là khoảng 4,5 Sv. Tương đương với liệu lượng hiệu quả đã cam kết Po-210 là 0,51 µSv/ Bq nếu ăn phải và 2,5 µSv/Bq nếu hít phải.
Một liều 4,5 Sv gây tử vong có thể do ăn phải 8,8 MBq (240 μCi), khoảng 50 nanogram (ng) hoặc hít phải 1,8 MBq (49 μCi), khoảng 10 ng. Do đó, theo lý thuyết một gam Po-210 có thể đầu độc 20 triệu người, trong đó 10 triệu người sẽ chết.
Tuy nhiên độc tính thực tế của Po-210 thấp hơn so với những ước tình này, do việc tiếp xúc với bức xạ trải dài trong vài tuần (thời gian bán hủy sinh học của Polonium ở người là 30 đến 50 ngày), ít gây hại hơn so với liều lượng tức thời.
Người ta ước tính rằng liều lượng gây chết người trung bình của Po-210 là một lượng cực kỳ nhỏ, khoảng 15 megabecquerel (0,41 mCi) hay 0,089 microgam (μg).
Ảnh hưởng mãn tính của Polonium
Ngoài các tác động cấp tính, việc tiếp xúc với bức xạ, cả bên trong lẫn bên ngoài đều có nguy cơ gây tử vong do ung thư lâu dài là 5-10% mỗi Sv.
Dân số nói chung tiếp xúc với một lượng nhỏ Polonium như việc hút thuốc lá, gây ra các ca tử vong do ung thư phổi ở Hoa Kỳ hàng năm lên đến 15.000-22.000 ca.
Giới hạn phơi nhiễm theo quy định và xử lý
Khối lượng tối đa cho phép khi ăn vào Po-210 chỉ là 1,1 kBq (30 nCi), tương đương với một hạt có khối lượng chỉ 6,8 picogram. Nồng độ tối đa cho phép của Po-210 trong không khí là khoảng 10 Bq/m3 (3×10−10 µCi/cm3).
Các cơ quan mục tiêu của Poloni ở người là lá lách và gan. Vì lá lách nặng 150g và gan nặng 1,3 đến 3kg, nhỏ hơn nhiều so với phần còn lại của cơ thể.
Nếu Polonium tập trung ở những cơ quan quan trọng này sẽ đe dọa tính mạng lớn so với trường hợp liều lượng trải đều khắp toàn bộ cơ thể như Cesium hoặc Tritium.
Po-210 được sử dụng rộng rãi trong công nghiệp và luôn sẵn có mà không cần nhiều quy định hoặc hạn chế.
Poloni và các hợp chất phải được xử lý trong hộp đựng găng tay và được đặt trong một hộp khác, duy trì ở áp suất cao để ngăn chất phóng xạ rò rỉ ra ngoài.
Găng tay làm bằng cao su tự nhiên không cung cấp đủ khả năng bảo vệ chống lại bức xạ từ Polonium, do vậy bạn cần sử dụng găng tay cao su tổng hợp tiêu chuẩn cao để che chắn bức xạ từ Polonium tốt hơn.

Thuốc lá
Polonium-210 có trong thuốc lá góp phần gây ra nhiều trường hợp ung thư phổi trên toàn thế giới. Hầu hết lượng Polonium này có nguồn gốc từ Pb-210 lắng đọng trên lá thuốc lá từ bầu khí quyển. Pb-210 là là sản phẩm của khí radon-222, phần lớn trong số này được bắt nguồn từ sự phân rã của Radium-226 từ phân bón cho đất cây thuốc lá.
Sự hiện diện của Polonium trong khói thuốc lá đã được biết đến từ đầu những năm 1960. Một số công ty thuốc lá lớn nhất thế giới đã nghiên cứu các cách để loại bỏ chất này trong khoảng 40 năm, nhưng không mang lại kết quả.

Thực phẩm
Polonium cũng được tìm thấy trong chuỗi thức ăn, đặc biệt là trong các hải sản.

Polonium là kim loại hiếm với hàm lượng phóng xa cao được ứng dụng vào các nghiên cứu khoa học và sản xuất công nghệ cao. Tuy nhiên Poloni đôi khi vẫn xuất hiện với số lượng nhỏ trong cuộc sống quanh chúng ta.


